En este ejercicio clínico se presenta un caso que es discutido por un médico internista al que se le van proporcionando datos de la historia clínica en forma secuencial, y este analiza el cuadro a la luz de los nuevos elementos, de una manera análoga al proceso diagnóstico en la práctica real de la medicina.
Un marinero de 24 años consultó al departamento de emergencias por un cuadro de siete días de evolución de dificultad respiratoria, dolor subesternal ocasional, aumento del diámetro de la cintura, náuseas y vómitos. Refirió que sus piernas estaban hinchadas y había aumentado 14 kg de peso durante las últimas tres semanas, mientras navegaba desde el Caribe hasta la isla de Nantucket en el noreste de los Estados Unidos. También refirió que antes de comenzar sus síntomas había estado en muy buen estado de salud como era lo habitual. No tomaba medicamentos, y no había estado en contacto con personas enfermas, no había estado expuesto a tuberculosis y no tenía factores de riesgo para la adquisición del virus de la inmunodeficiencia humana.
Este joven previamente sano comenzó con disnea en el contexto de un aumento significativo de peso. El grado de aumento de peso, así como el tiempo en que se produjo, son sugestivos de un proceso subagudo. El diagnóstico diferencial es amplio e incluye patologías cardíacas, hepáticas, pulmonares y renales.
En el examen físico, el paciente presentaba los siguientes signos vitales: presión arterial 127/82 mm Hg; frecuencia cardíaca 102 latidos por minuto; temperatura 37,4ºC, frecuencia respiratoria de 26 por minuto. La saturación de oxígeno era de 96 por ciento mientras respiraba oxígeno suplementario al 100 por ciento. No se detectaba pulso paradójico. El paciente impresionaba en regular estado general pero podía emitir frases completas. Sus escleras no estaban ictéricas. La presión venosa yugular no estaba elevada. Los pulmones se auscultaban con los ruidos respiratorios disminuidos y había matidez hasta la mitad inferior de ambos hemitórax. El primer y segundo ruidos eran normales sin frotes soplos ni galope. El examen abdominal reveló leve dolor en el cuadrante superior derecho y una onda líquida sin hepato ni esplenomegalia. El paciente tenía edema 3 + bilateralmente y no tenía alteraciones articulares, rash cutáneo, ictericia, ni linfadenopatías. Su esatdo de conciencia era normal. La Rx de tórax reveló una silueta cardíaca aumentada de tamaño, con moderado derrame pleural bilateral, sin inflitrados ni edema intersticial (Figura 1).

Figura 1.
Tele Rx de tórax que muestra agrandamiento de la silueta cardíaca con moderado derrame pleural bilateral, sin infiltrados ni edema intersticial.
El paciente tiene evidencias de líquido en los espacios pleurales y peritoneal, y de acuerdo a la Rx de tórax, también derrame pericárdico. Es necesario llevar a cabo una tóracocentesis con examen del líquido pleural para determinar si esto es o no un trasudado debido a aumento de presión hidrostática o por reducción de la presión oncótica, o si se trata de un exudado, que podría ser sugestivo de un proceso inflamatorio, infeccioso o cáncer. Los problemas cardíacos que causan aumento de la presión hidrostática y los problemas hepáticos o renales que causan reducción del nivel de las proteínas séricas, pueden conducir a acumulación de líquido en los espacios pleurales, pericárdico y peritoneal. Los procesos inflamatorios causan edema intersticial infrecuentemente; aunque muchas superficies serosas pueden estar afectadas, las colecciones localizadas son más comunes.
Aunque un paciente con infección viral puede presentarse con serositis difusa, el curso en el tiempo de la enfermedad de este paciente, así como la ausencia de mialgias o síntomas sistémicos serían atípicos para un cuadro viral. Las causas bacterianas de serositis difusa son poco frecuentes, pero ocasionalmente la neumonía con derrame paraneumónico puede ocurrir con derrame pericárdico; la ascitis en ese caso sería muy improbable. La tuberculosis puede desarrollar insidiosamente, con derrame pleural, pericárdico y peritoneal. Otra causa común de serositis difusa es la enfermedad colágeno-vascular, incluyendo la enfermedad de Still, el lupus eritematoso sistémico y la enfermedad mixta del tejido conectivo. La fiebre Mediteránea Familiar tendría que considerarse si el paciente tuviese antecedentes de episodios recurentes de serositis y fiebre.
La presencia de ascitis aumenta la probabilidad de cirrosis con elevación de la presión portal. Una presión venosa yugular normal argumenta en contra de disfunción cardíaca con aumento de presión hidrostática. Sería necesario ver los análisis del líquido pleural, un recuento completo de sangre, tests de anticuerpos antinucleares, análisis de orina etc.
Los electrolitos séricos estaban dentro de rangos normales. La glucemia era de 109 mg/dl; la urea de 20 mg/dl; la creatinina de 1,9 mg/dl; aspartato aminotransferasa (TGO) 855 U/litro; alanino aminotransferasa (TGP) 822 U/litro; bilirrubina total 1,2 mg/dl; fosfatasa alcalina 99 U/litro; albúmina 3,0 g/dl; y LDH 52 U/litro. El recuento de glóbulos blancos era de 11.000/mm3, la hemoglobina de 13,1 g/dl, y el recuento de plaquetas de 285.000/mm3. El RIN fue de 1,5. Los anticuerpos antinucleares fueron negativos. Un dipstick (tiras reactivas) de orina no mostró alteraciones.
El análisis del líquido pleural mostró que el pH era de 8,0, la glucosa de 83 mg/dl, LDH de 98 U/litro, las proteínas de 2,9/dl. El recuento de blancos en el líquido era de 220/mm3, con 8 por ciento de neutrófilos, 68 por ciento de linfocitos, 13 por ciento de macrófagos, y 11 por ciento de células mesoteliales. Los cultivos bacteriológicos, los tests citológicos, y las tinciones para bacilos ácido alcohol resistentes fueron negativos. Un ecocardiograma transtorácico mostró función ventricular izquierda y derechas conservadas, con derrame pericárdico de moderado a grande, sin evidencias de taponamiento cardíaco.
El valor de albúmina relativamente normal descarta que las colecciones líquidas sean debidas a disminución de la presión oncótica. Una colagenopatía es improbable a la luz de los anticuerpos antinucleares negativos y la ausencia de otros signos o síntomas característicos. La relación de LDH entre líquido pleural y LDH sérica es mayor de 0,6, lo cual es consistente con exudado. El pH del líquido pleural es mayor de lo normal, indicando posiblemente la presencia de una burbuja de aire en la jeringa usada para la toma de la muestra. Un predominio linfocitario es visto en la tuberculosis y el cáncer, y argumenta contra la infección bacteriana. La presencia de células mesoteliales y la tinción negativa para bacilos ácido alcohol resistentes reducen la probabilidad de tuberculosis, pero el extendido tiene baja sensibilidad. El cáncer permanece siendo una consideración, a pesar de los resultados negativos en los análisis serológicos, ya que una única muestra de líquido pleural tiene un rédito de menos de 50 por ciento en el diagnóstico de cáncer. La biopsia pleural puede aumentar la sensibilidad de detección.
El paciente fue tratado con diuréticos intravenosos durante los siguientes cuatro días, con lo cual mejoró su disnea y el edema. En el sexto día de hospital, el paciente vomitó dos veces y tuvo un inicio súbito de dificultad respiratoria y dolor abdominal. Se volvió hipotenso y taquicárdico. Una angio TC mostró pequeñas embolias en varias arterias pulmonares derechas subsegmentarias, así como en la arteria pulmonar principal izquierda. Se comenzó tratamiento con heparina.
La embolia pulmonar por si sola, no explica todos los hallazgos de este paciente, y probablemente la misma se deba a complicación de la hospitalización, o de alguna enfermedad de base hasta ahora desconocida. Aunque el infarto pulmonar puede causar un derrame pleural exudado, la embolia pulmonar aguda no se asocia a derrame pericárdico ni ascitis. El tromboembolismo pulmonar crónico con hipertensión pulmonar y aumento de las presiones de llenado ventricular derecho puede resultar en un cuadro clínico de edema periférico, ascitis y derrame pleural, pero en ese caso hubiésemos tenido un trasudado en lugar de un exudado. En este punto, el diagnóstico de cáncer es una fuerte consideración, pero debe descartarse causas infecciosas o colágeno vasculares que no han sido descartadas.
Un eco Doppler de extremidades inferioresno mostró trombosis venosa profunda. El paciente era capaz de mantener una saturación de oxígeno de 92 a 93 por ciento respirando oxígeno suplementario al 100 por ciento.
El paciente estaba disneico, taquicárdico e hipotenso, con derrame pericárdico y embolia pulmonar. No hay evidencias de disfunción ventricular derecha severa en el ecocardiograma, y por lo tanto, es improbable que la hipotensión sea secundaria a la embolia de pulmón. Sería interesante una nueva medida de la presión venosa yugular. Es difícil determinar si el derrame pericárdico contribuía a esa inestabilidad. Aunque la ausencia de signos ecocardiográficos de taponamiento es muy importante para descartar este mecanismo de hipotensión, tales signos pueden estar enmascarados por la hipertensión pulmonar debido a la combinación de vasoconstricción hipóxica y embolia pulmonar. El tamaño del derrame pericárdico sugiere un proceso subagudo. El derrame puede aumentar con la anticoagulación.
La causa de un derrame pericárdico puede ser difícil de diagnosticar. Las posibilidades incluyen infección, cancer, radiación, enfermedades del colágeno, hipotiroidismo, trauma y uremia. Yo sugeriría una medición hemodinámica invasiva para ayudar a descartar taponamiento cardíaco. La pericardiocentesis en un paciente con taponamiento cardíaco sería terapéutica y además ayudaría al diagnóstico específico en un paciente en estas condiciones.
Se llevó a cabo una pericardiocentesis. La presión pericárdica inicial fue de 24 mm Hg (normal entre -3 a -6 mm Hg). No se llevaron a cabo mediciones de presión en ventrículo derecho por la preocupación de que un émbolo pudiera ser desprendido de la pared de la arteria pulmonar durante la colocación del catéter arterial pulmonar. Después de la extracción de 800 ml de líquido hemorrágico del espacio pericárdico, la presión pericárdica cayó a 3 mm Hg. Se dejó colocado un catéter de drenaje en el espacio pericárdico.
El análisis del líquido pericárdico reveló que el nivel de glucosa era de 83 mg/dl, la LDH de 163 U/litro, el nivel de proteínas de 4,7 g/litro, y el hematocrito de 41,5 por ciento. El recuento de blancos era de 4900/mm3, con 49 por ciento de neutrófilos, 1 por ciento en banda, 30 por ciento linfocitos, 12 por ciento monocitos, 1 por ciento eosinófilos, 6 por ciento macrófagos y 1 por ciento de células rojas nucleadas.
Un hematocrito de 41 por ciento indica la presencia de sangre franca; el hematocrito sería menor si un sangrado intrapericárdico lento hubiese complicado a un derrame inicialmente no hemático. La historia clínica del paciente no es compatible con hemopericardio complicando a un infarto agudo de miocardio, disección aórtica, o trauma de tórax. Un proceso inflamatorio agresivo, una diátesis hemorrágica, o la erosión de un tumor primario o metastásico es un motivo de preocupación. Una preocupación inicial cuando el líquido es francamente hemorrágico, es que la aguja de pericardiocentesis haya perforado la cámara y entrado al ventrículo derecho, o lacerado una arteria, pero en ese caso no cabría esperar que la presión pericárdica cayera, las variables hemodinámicas mejoren, o el derrame se resuelva si alguna de esas complicaciones hubiera ocurrido.
Un ecocardiograma confirmó la resolución del derrame. La disnea y la taquicardia mejoraron, y la presión arterial permaneció estable. La infusión de heparina fue reiniciada. Los cultivos para bacterias del líquido pericárdico, los análisis citológicos, y las tinciones para bacilos ácido alcohol resistentes fueron negativos. El día 8 de internación, la TC de tórax se repitió.
La decisión de reiniciar la administración de heparina, teniendo colocado un catéter de drenaje en el espacio pericárdico fue apropiada, sobre todo si se temía por otro episodio de embolismo pulmonar que pudiera descompensar al paciente. Teniendo un catéter de drenaje colocado correctamente en su lugar, la posibilidad de resangrado y taponamiento cardíaco es remota. Ahora es el momento de estudiar las causas del hemopericardio inexplicado en busca de un proceso unificador que explique la totalidad del cuadro.
La angio-TC mostró embolias pulmonares no obstructivas en las arterias pulmonares principales. Múltiples pequeños defectos de relleno dentro de las arterias segmentarias del lóbulo superior izquierdo y lóbulo superior derecho. El catéter pericárdico fue removido 48 horas más tarde, una vez que el débito bajo a cero. Se comenzó con warfarina y cuando los valores de RIN fueron adecuados se interrumpió la heparina.
Un ecocardiograma transtorácico reveló sólo un pequeño derrame pericárdico circunferencial sin signos de taponamiento. Con el aumento de la diuresis, el peso corporal del paciente volvió a lo normal y la disnea se resolvió completamente. Una evaluación para hipercoagulabilidad reveló que el paciente era heterocigota para la mutación del factor V Leiden.
En el servicio de Clínica Médica se interpretó el cuadro como derrame pericárdico post-viral o idiopático, con sangrado en el espacio pericárdico causado por la anticoagulación. Embolismo pulmonar debido a reposo en el contexto de hipercoagulabilidad. La retención de líquidos, ascitis, derrame pleural fueron atribuidos a altas presiones de llenado en el corazón derecho en el contexto de taponamiento cardíaco subagudo. El paciente fue dado de alta el día 19.
La pregunta ahora es si el paciente necesita anticoagulación de por vida. Él tiene un estado hipercoagulable debido a una alteración genética. Esta alteración resulta en la incapacidad de la proteína C en su rol anticoagulante fisiológico. Los pacientes con la mutación del factor V de Leyden están más propensos a la trombosis venosa y a la embolia pulmonar. Más de la mitad de las trombosis venosas profundas, en algunas poblaciones seleccionadas obedecen a la mutación del factor V de Leyden. En otras en cambio el porcentaje es menor. Este es un paciente joven y activo que trabaja como marino, por lo que el planteo a discutir es si requiere anticoagulación más allá de los seis meses después de su embolia de pulmón.
Tres semanas más tarde, el paciente notó un dolor pleurítico en el lado derecho del tórax por lo que consultó nuevamente al departamento de emergencias del hospital. El RIN era de 1,6. Se le realizó una nueva angio-TC que mostró resolución del derrame pleural, y derrame pericárdico loculado, adyacente al lado derecho del corazón. No había nuevos émbolos pulmonares. Un ecocardiograma transtorácico reveló crecimiento del derrame pericárdico con evidencias ecocardiográficas de taponamiento cardíaco. Se planificó una biopsia y realización de una ventana pericárdica.
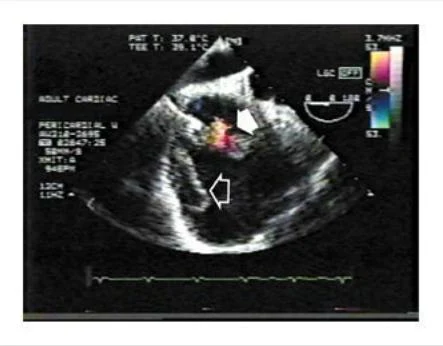
Un ecocardiograma transesofágico que fue llevado a cabo antes del procedimiento, reveló un derrame pericárdico tabicado y lobulado, una masa ecodensa alrededor de la aurícula derecha, con comunicación con la cavidad de la aurícula derecha. El Doppler colo después de la administración de material de contraste reveló una comunicación entre la aurícula derecha y el espacio pericárdico (Figura 2 ). El espacio pericárdico medía 4 cm por 9 cm y el defecto en la aurícula derecha medía 5 mm. La realización de una ventana pericárdica fue abortada.
Figura 2. Eco Doppler Color Obtenido Durante el Ecocardiograma Transesofágico.
La imagen muestra flujo a través de una comunicación entre la aurícula derecha (flecha sólida) y el espacio pericárdico, donde la masa puede ser vista (flecha abierta).
Cuál es el Diagnóstico?
Un tumor metastásico es lejos la causa más común de tumores cardíacos. Ellos ocurren 20 a 40 veces más frecuentemente que los tumores cardíacos primarios. El cáncer de pulmón es el cáncer que con más frecuencia metastiza al corazón, seguido por el cáncer de mama y el carcinoma de células renales, así como el melanoma y el linfoma. El tumor de células germinales también debe considerarse en un paciente joven debido a que este tipo de tumores ocurren con una frecuencia de distribución bimodal con un pico entre los 10 y 20 años. La causa más común de tumor cardíaco benigno es el mixoma auricular, el cual tiene predilección por la aurícula izquierda. Con respecto a los tumores malignos primarios del corazón, varios subtipos de sarcomas son los más comunes. La naturaleza invasiva de esta masa es sugestiva de neoplasia maligna.
Un día más tarde, el paciente fue llevado nuevamente a la sala de cirugía para reparación de la perforación de la aurícula derecha y pericardiectomía. Varios trombos, y una gran masa fueron identificados dentro del espacio pericárdico. La masa se extendía desde el espacio pericárdico a través de la perforación de la aurícula derecha y a la aurícula derecha. No se notó compromiso pleural.
Una tinción con hematoxilina-eosina del pericardio y de la masa auricular derecha reveló trombos organizados y áreas de una configuración papilar mostrando canales vasculares anastomosados tapizados con células atípicas de con núcleos hipercromáticos. (Figura 3).
Figura 3. Muestra de Tejido de la Masa Pericárdica y de Aurícula Derecha (Hematoxilina-Eosina).
Un trombo en vías de organización con una configuración papilar y canales vasculares anastomosados son visibles (Panel A). A mayor magnificación, canales vasculares que son tapizados por células atípicas con células atípicas y núcleos hipercromáticos (Panel B).
La tinción inmunohistoquímica para CD15 (Leu-M1), citokeratina, proteína S-100, cromogranina, y calretinina fueron negativos, lo cual descartó mesotelioma maligno. La tinción para factor VIII, Ulex europaeus, CD34, y CD31 fueron positivos.
Los diagnósticos diferenciales histológicos más importantes con estos elementos son ahora el angiosarcoma y el mesotelioma papilar maligno. Los resultados de la tinción inmunohistoquímica, el grado de atipía citológica, y la naturaleza infiltrativa de la lesión son sugestivos de angiosarcoma.
Los sarcomas son particularmente agresivos, y desafortunadamente no existen terapias muy efectivas. Los sarcomas de partes blandas como este, responden a doxorrubicina e ifosfamida a veces con regresión parcial. El tratamiento de los sarcomas primarios de corazón es el transplante cardíaco pero es controvertido. El transplante no es aquí una opción, ya que la enfermedad no está localizada. Es también posible, que el tumor haya comenzado fuera del corazón y lo haya erosionado, lo cual condujo a embolismo pulmonar.
El paciente falleció 6 meses después.
Comentario.
Los médicos que participaron en este caso estuvieron muy sorprendidos por la poco común enfermedad de este paciente. Hay factores que hicieron más difícil el diagnóstico en este caso además de la poco frecuente prevalencia de un tumor cardíaco primario maligno. La no visualización del tumor en un ecocardiograma transtorácico y en la TC de tórax, asociado al embolismo pulmonar concomitante. El derrame pleural exudado y la presencia de sangre franca en el espacio pericárdico sin una causa clara sugieren una enfermedad neoplásica, más que un derrame pleural idiopático exacerbado por la anticoagulación, como se pensó en un momento.
El angiosarcoma cardíaco explica muchos de los hallazgos de este paciente, tales como la ascitis y el edema periférico debido a obstrucción del corazón derecho, el hemopericardio, la perforación de la cámara auricular y la embolia pulmonar, más probablemente embolismo tumoral, y derrame pleural maligno. Aún así, el diagnóstico se mostró esquivo hasta que el tumor fue visto por ecocardiograma transesofágico. La mayoría de los tumores cardíacos pueden ser vistos con ecocardiograma transtorácico, pero la localización de este tumor adyacente a la aurícula derecha limitó su visualización en la ecocardiografía convencional y en la TC. Aunque la ecocardiografía transesofágica ha demostrado tener alta sensibilidad para la detección de tumores de aurícula derecha (1) y la invasión intracardíaca y crecimiento tumoral, (2) el uso de rutina sin sospecha previa de un tumor cardíaco en el estudio de un derrame pericárdico, tiene baja sensibilidad diagnóstica.
Más de tres cuartos de los tumores cardíacos son mixomas benignos, fibromas, o lipomas. Los tumores cardíacos primarios son extremadamente raros, y y el angiosarcoma cardíaco da cuenta del 25 por ciento de esos tumores. (3) Estos son raros tumores de origen mesenquimático compuestos de células malignas que forman canales vasculares. El angiosarcoma aparece más a menudo en el lado derecho del corazón, particularmente en la aurícula derecha o en el pericardio con un pico de incidencia entre la tercera y cuarta décadas de la vida. (4) Un efecto de masa intracavitaria es común, igual que las metástasis. El hemopericardio o la obliteración del espacio pericárdico por células tumorales y trombos, pueden ser complicaciones. (5,6) La ruptura espontánea de un angiosarcoma es extremadamente rara. (7,8) El promedio de sobrevida después del diagnóstico es de menos de un año, (4) pero el tratamiento exitoso con radioterapia combinada con quimiterapia y seguido de transplante cardíaco ha sido reportado. (9)
Fuente
From the Divisions of Cardiology (D.S.P.), Infectious Diseases (B.M.B.), and Pulmonary and Critical Care Medicine (R.M.S.), and the Department of Medicine (C.C.S.), Beth Israel Deaconess Medical Center and Harvard Medical School, Boston.
Conclusiones del Caso.
Quedan algunos puntos oscuros en el análisis de este caso. Este paciente de 24 años consultó por disnea de siete días de evolución, y anasarca con aumento de 14 kg de peso de tres semanas de evolución. ¿Cuál es el mecanismo de ambos?
Lo más atinado a pensar es que el paciente presentó tromboembolismo pulmonar subagudo, hipertensión pulmonar, y un cuadro de fallo cardíaco derecho con taponamiento cardíaco subagudo, que lo llevó a edema generalizado, derrame pleural bilateral y ascitis. El tromboembolismo de hecho, fue confirmado por angiotomografía de tórax.
Sin embargo, hay elementos discordantes desde el punto de vista semiológico.
En el contexto de un paciente con anasarca, uno de los elementos semiológicos que da mayor información, y que el clínico busca rápidamente en el examen físico, es la inspección del cuello, para ver el grado de repleción venosa yugular. Si se observa ingurgitación yugular, y sobre todo si esta no colapsa con la inspiración, se objetiva aún con el enfermo a 45º o directamente sentado, y si además presenta una maniobra de reflujo hepatoyugular positiva, el origen cardiovascular del problema queda decretado en la mente del clínico. A partir de allí buscaremos si el paciente tiene una insuficiencia cardíaca, si esta es izquierda, derecha, biventricular, si tiene derrame pericárdico, si tiene signos de taponamiento cardíaco, si tiene constricción pericárdica, si tiene elementos semiológicos de hipertensión pulmonar como una maniobra de Dressler positiva, latido sagital etc. Lo inverso también es cierto; la ausencia de repleción venosa, y la ausencia de reflujo hepatoyugular hacen que por lo menos inicialmente sospechemos que el corazón o el pericardio, no son responsables del cuadro.
En el examen de este paciente no se habla en ningún momento de aumento de presión venosa en cuello, sino todo lo contrario, marcando explícitamente “la presión venosa yugular no estaba aumentada”. Tampoco tenía hepatomegalia ni reflujo hepatoyugular, y sólo menciona “el examen abdominal reveló leve dolor en el cuadrante superior derecho”.
Un diagnóstico a considerar en este paciente, y que hasta donde se puede leer en la historia clínica no fue descartado totalmente es el síndrome de Budd-Chiari subagudo/crónico. El paciente tenía factores de riesgo para presentarlo ya que presentaba un síndrome de hipercoagulabilidad congénito y otro adquirido. El síndrome de Budd-Chiari podría explicar la ascitis en ausencia de ingurgitación yugular y de reflujo hepatoyugular, dolor en hipocondrio derecho, y podría ser causa además, de las alteraciones que presentaba en el hepatograma, que como veremos más adelante, son difíciles de atribuir a un hígado congestivo secundario a insuficiencia cardíaca.
Así, como dijimos, este paciente tenía condiciones más que suficientes para tener un tromboembolismo pulmonar, que de hecho fue confirmado, con algún grado de repercusión en cavidades derechas. Tenía una coagulopatía de base, consistente en una mutación del factor V de Leiden, lo que hacía que su proteína C activada no pudiera ejercer su función de anticoagulante natural, clivando al factor V, e interrumpiendo de esa manera la cascada de la coagulación. Esta alteración genética que el paciente padecía seguramente desde su nacimiento no se expresó clínicamente hasta que otro factor como en este caso una neoplasia la pusiera de manifiesto (el “second hit” de los autores Ingleses). Como casi todas las neoplasias, este sarcoma es un factor trombogénico, pero lo es más aún debido a su localización en aurícula derecha, condicionando disrupción del endotelio y alteraciones mecánicas con trombosis agregada sobre el tumor. Es difícil saber sin los resultados anatomopatológicos si el material embólico contenía además tejido neoplásico (embolia tumoral), lo cual no parece por lo menos por los hallazgos de la Rx de tórax y de la TC que hablan de parénquima pulmonar normal.
¿Por qué tuvo este paciente anasarca? no lo sabemos, aunque se puede especular con dos hipótesis, la primera es que el examen físico inicial haya sido deficitario, y que el paciente tuviera signos de hipertensión venosa, y la segunda es que el paciente estuviera cursando un cuadro de tromboembolismo pulmonar intermitente, que la hipertensión pulmonar descendiese a valores normales por mecanismos compensatorios fuera de los episodios agudos de embolia, y que el examen físico haya sido realizado en uno de esos episodios intercríticos, observándose solamente el edema generalizado cuya resolución toma más tiempo.
La teoría esbozada en alguna parte del análisis de que el derrame pleural y la ascitis fuesen de etiología neoplásica es difícil de sostener por varios motivos. El aspecto del líquido (no hemorrágico), la ausencia de LDH en niveles excesivamente altos como suele verse en derrames pleurales neoplásicos, la ausencia de células neoplásicas en el estudio citológico, y sobre todo por el comportamiento, con desaparición del mismo como consecuencia de la terapia diurética.
El derrame pleural era sin embargo un exudado de acuerdo a un criterio de Light que en este caso es la relación mayor de 0,6 entre la LDH del líquido respecto de la del suero. Una explicación es que el tromboembolismo pulmonar puede dar ambos tipos de derrame pleural, trasudado o exudado.
Un elemento más de confusión en este caso fue la presencia de derrame pericárdico de moderado a severo. Un derrame pericárdico en el contexto de anasarca con importante edema, derrame pleural y ascitis, no es raro de ver en insuficiencia cardíaca, síndrome nefrótico, síndrome ascítico edematoso de causa hepática etc, pero siempre que el derrame pleural o la ascitis sean trasudados. En este caso, la presencia de un derrame pleural exudado hizo sospechar que el derrame pericárdico fuera parte de una poliserositis viral, bacteriana, tuberculosa, o colagenopática. Sin embargo, la evolución del cuadro se encargó de demostrar que el derrame pericárdico fue de entrada neoplásico. Inicialmente no hubo compromiso hemodinámico de tipo de taponamiento cardíaco, aunque probablemente haya contribuido en alguna medida al cuadro. Posteriormente en la evolución aparece un taponamiento cardíaco.
Otro dato difícil de enmarcar en el cuadro de este paciente es el importante aumento de los niveles de transaminasas en el hepatograma. En el único resultado que consta en la historia, presumiblemente del ingreso, se observa un nivel de alanino aminotransferasa de 822 U/litro y de aspartato aminotransferasa de 855 U/litro. Llamativamente el resto del hepatograma era prácticamente normal, con una fosfatasa alcalina de 99 U/litro, y una bilirrubiba total de 1,2 mg/dl, conformando un patrón típicamente citolítico.
La llamada hepatopatía congestiva, cuya principal causa es la insuficiencia cardíaca derecha, produce una variedad de manifestaciones clínicas y humorales. De las manifestaciones clínicas, quizás la más específica sea el reflujo hepatoyugular, que es un elemento semiológico de gran ayuda al momento de diferenciar una hepatomegalia congestiva de una patología primaria del hígado, excepto en el síndrome de Budd-Chiari, en el que a pesar de que la hepatomegalia es congestiva, no se observa reflujo hepatoyugular como consecuencia de la obstrucción a nivel de las venas suprahepáticas.
De las alteraciones del hepatograma en la insuficiencia cardíaca, la más constante es el aumento de la bilirrubina, a expensas de su fracción indirecta, usualmente por debajo de 3 mg/dl, pero lo suficiente como para que estos pacientes tengan ictericia conjuntival. De hecho, el aumento de la bilirrubina total es un predictor de morbi/mortalidad en el contexto de insuficiencia cardíaca. Pacientes con corazón pulmonar agudo severo, como se puede ver en el embolismo pulmonar masivo o submasivo, pueden verse niveles mucho más altos de bilirrubina. La causa del aumento de la bilirrubina no es del todo conocida, pero probablemente sea multifactorial, por factores como la disfunción hepatocelular y fallo en la conjugación, hemólisis, infarto pulmonar, obstrucción canalicular por venas hepáticas distendidas, medicación, y sepsis sobreimpuesta.
La fosfatasa alcalina generalmente es normal, o está solo mínimamente elevada, y las transaminasas están elevadas en un tercio de los pacientes pero nunca por encima de dos o tres veces el valor normal. Los aumentos mayores en los niveles de transaminasas se suelen ver ocasionalmente, pero en el contexto de pacientes con bajo gasto cardíaco, o directamente shock cardiogénico, sobre todo cuando este estado hemodinámico coexiste con fallo cardíaco retrógrado e hipertensión venosa, y es debido a hepatopatía isquémica y necrosis de la zona 3 del hígado, es decir las zonas próximas a la vena central del lobulillo, que es la zona que más sufre la isquemia. En estos casos pueden verse los niveles más altos de transaminasas conocidos (más de 1000 o hasta más de 50 veces los valores normales).
Si bien este paciente estuvo hipotenso posteriormente en el curso de la evolución como consecuencia de tromboembolismo pulmonar recurrente y taponamiento cardíaco subagudo, esto fue posterior a la muestra de sangre inicial a la que corresponde este hepatograma, y por lo tanto no explica las alteraciones del mismo, las cuales no corresponden a las descriptas clásicamente en el hígado congestivo. Por lo tanto quedó sin aclarar ese aumento importante de transaminasas. Como dijimos antes, El síndrome de Budd-Chiari podría explicar algunos elementos en este paciente, entre ellos las alteraciones del hepatograma.
Por último digamos que es llamativa la explicación simplista que hicieron los clínicos que atendieron a este paciente en la primera internación, que fue de derrame pericárdico post-viral con sangrado iatrogénico intrapericárdico por la anticoagulación indicada a su vez por TEP en el contexto de hipercoagulabilidad congénita, y anasarca como consecuencia de taponamiento cardíaco subagudo. Es como armar un modelo con piezas de diferente tamaño y color. Seguramente esta hipótesis no convenció a ninguno de los médicos que le otorgaron el alta, y la mayoría de ellos sintió que el paciente iba a regresar, pero ya con evidencias de su verdadero diagnóstico como ocurrió finalmente.
Es moneda corriente en la práctica médica que arribemos a diagnósticos, o que suscribamos hipótesis explicativas que no nos convencen plenamente, pero que sin embargo adoptamos como válidas. Es como si en un punto se agotaran todas las instancias diagnósticas, a lo que se agregan muchas veces el hastío del paciente y sobre todo del médico en seguir realizando estudios hasta ese momento inconducentes.
A veces en estos casos, es válido tomarse un respiro, a la espera de que la enfermedad se exprese, y de hecho muchas veces eso sucede. Detener la marcha de los estudios diagnósticos es a veces saludable, sobre todo cuando no existe un rumbo fijo. Pero lamentablemente esto no siempre es así, y algunas veces es tarde como en este caso, cuando encontramos la última pieza del rompecabezas.