Autor/a: Luke Howard Clinical Medicine 2019 Vol 19, No 3: 243–7.
| Introducción |
La embolia pulmonar (EP) es un diagnóstico de presentación frecuente en el departamento de emergencias.
Puede presentarse con rasgos clásicos, como la disnea y el dolor torácico pleurítico, pero también menos característicamente, por ejemplo, con falta de aire en forma insidiosa que se inicia durante días a semanas, o síncope, con relativamente pocos síntomas de las vías respiratorias.
Por lo tanto, los médicos deben tener un elevado índice de sospecha de la EP en los pacientes que presentan síntomas cardiopulmonares, ya que las consecuencias de la falta de diagnóstico o su retraso pueden ser graves.
Como en la mayoría de otras áreas de la medicina, se ha desarrollado un gran protocolo para el diagnóstico y manejo de la EP, pero todavía hay muchas áreas grises en la toma de decisiones, requiriendo experiencia tanto clínica como en la toma de decisiones.
| Diagnóstico |
Los algoritmos y técnicas de diagnóstico no han experimentado muchos cambios en los últimos 10 años, siendo la herramienta diagnóstica principal, la angiografía pulmonar por tomografía computarizada (APTC).
Debido a que la APTC implica el uso de radiación ionizante, su utilización no es apropiada para todos los casos sospechosos de EP, de ahí la utilización del dímero-d para seleccionar a aquellos pacientes con baja probabilidad de EP.
Si bien hay varios sistemas de puntaje de probabilidad clínica, el puntaje de Wells sigue siendo el algoritmo de referencia más usado internacionalmente.
Cuando la probabilidad clínica de EP es baja, un dímero-d normal tiene valor predictivo negativo elevado para excluir la EP, pero, cuando hay un aumento del dímero-d o la probabilidad de EP es elevada, se debe realizar una imagen diagnóstica.
Sin embargo, cada vez hay más interés en el uso del dímero-d ajustado a la edad. La evidencia aún no ha alcanzado suficiente importancia como para ser considerado parte de la practica rutinaria.
En determinadas circunstancias, en particular el embarazo, la inflamación y el cáncer, el dímero-d no se puede ser utilizado para clasificar a los pacientes para su estudio por imágenes.
Una estrategia alternativa a la TC es cuando hay que evitar la radiación ionizante, es el uso del Eco-doppler de las venas de las piernas, como ocurre en las embarazadas, pero, en ausencia de embarazo, esta estrategia no tiene el rendimiento suficiente para justificar su uso, ya que los hallazgos positivos son aproximadamente de 1 cada 10 casos.
Cuando la radiografía de tórax es normal, se puede utilizar el escaneo ventilación/perfusión (VQ), con la mitad de la dosis, siendo también una opción para las embarazadas.
Con el avance de la tecnología, la APTC puede detectar defectos de relleno más pequeños de la circulación pulmonar. Si el médico tiene la certeza de que estos defectos de llenado son embolias pulmonares genuinas, cobra importancia, pues le permite evaluar si tales coágulos pequeños tienen influencia en la presentación, por ejemplo, si se hallan en un subsegmento aislado o la EP es suficiente como para provocar un síncope.
Por el contrario, si la opacificación del contraste es pobre o se trata de un artefacto respiratorio, los escaneos pueden ser malinterpretados como pequeños émbolos periféricos, o no haber acuerdo entre los observadores cuando las embolias son <6 mm o subsegmentarias.
Dada la importancia de las consecuencias del diagnóstico de EP, como la necesidad de una anticoagulación para toda la vida, es esencial que en estas circunstancias los escaneaos sean revisados cuidadosamente y, a veces, considerar su repetición u optar por una modalidad diferente.
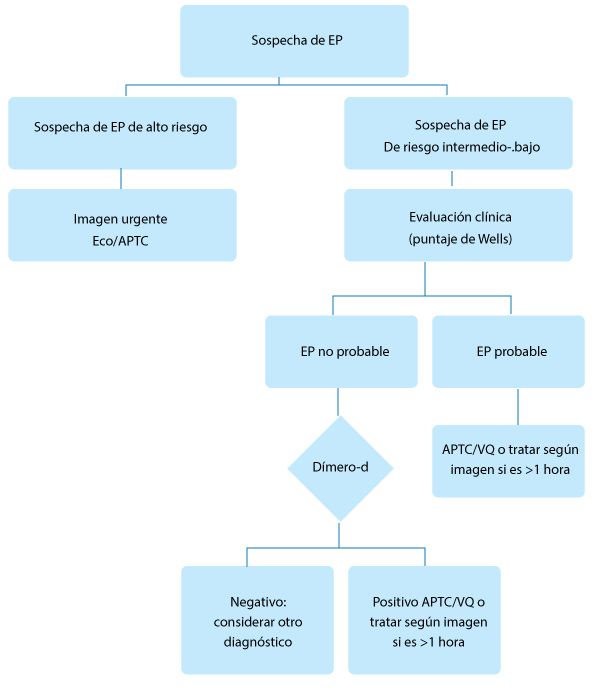 |
Diagnóstico de embolia pulmonar (basado en la Sociedad Europea de las guías de cardiología y del Instituto Nacional de Salud y Atención European Society of Cardiology guidelines and National Institute for Health and Care Excellence (NICE). a Paro cardìaco; presión arterial sistólica <90 mmHg o caída de ≥40 mmHg durante 15 minutos no relacionados con la arritmia de reciente comienzo, hipovolemia o sepsis. APTC: angiografía pulmonar por tomografía computarizada. EP = embolia pulmonar; VQ = ventilación de perfusión. |
| Estratificación del riesgo |
La estratificación del riesgo desempeña un papel importante en el manejo de una EP sospechada y confirmada. La lisis sistémica está indicada para la EP de alto riesgo (anteriormente conocida como masiva) o en el contexto de sospecha de un paro cardíaco por EP.
Si la lisis está contraindicada, se debe considerar la embolectomía quirúrgica.
Este grupo representa una proporción relativamente pequeña de pacientes que presentan EP (<5%) y el mayor desafío es identificar a los pacientes que no son de alto riesgo, en quienes la terapia de trombólisis/reperfusión debe ser aplicada.
La guía de la European Society of Cardiology (ESC) fue pionera en el concepto del tratamiento basado en los riesgos. Existen muchos puntajes de riesgo clínico, pero quizás el que ha ganado mayor popularidad es el Pulmonary Embolism Severity Index (PESI) y su posterior versión simplificada (sPESI).
Estos dos puntajes se pueden hacer al lado de la cama del paciente, usando la historia clínica y simples observaciones; se considera que el paciente es de riesgo intermedio cuando tiene un PESI clases III–V o un sPESI >0. Estos pacientes representan una gran cohorte y la mayoría no se beneficiará de la trombólisis y, por lo tanto, se requiere una mayor estratificación del riesgo.
Las pautas de la ESC sugieren que los pacientes de riesgo intermedio que también tienen un biomarcador cardíaco elevado, como la troponina o el N-terminal pro-péptido natriurético cerebral, además de signos de disfunción ventricular derecha en la TC o la ecocardiografía, deben ser catalogados como de riesgo intermedio-alto y ser considerados para el tratamiento de trombólisis/reperfusión.
Sin embargo, el Pulmonary Embolism International Thrombolysis Trial (PEITHO), un gran estudio de más de 1.000 pacientes con este perfil de riesgo, no demostró un beneficio en la mortalidad con la trombólisis, a los 7 o 30 días, pero comprobó una aumento significativo de los eventos adversos relacionados con el sangrado.
En el estudio de extensión, los resultados a largo plazo, incluida la incidencia de enfermedades crónicas, como la hipertensión pulmonar tromboembólica, no fueron diferentes.
Al comparar con la mortalidad esperada por el puntaje PESI, el riesgo general de mortalidad fue bajo a corto plazo en el estudio PEITHO, aproximadamente el 2%, lo que puede reflejar un mejor manejo general del paciente como parte de un ensayo clínico, una observación más cercana o un sesgo por la exclusión en el estudio de pacientes de mayor riesgo, según el criterio clínico.
Por lo tanto, continúa la necesidad de identificar otro subgrupo de pacientes de riesgo intermedio-alto que podría beneficiarse de una terapia más agresiva.
Un estudio ha sugerido que los pacientes con una combinación de sPESI >0, péptido natriurético cerebral y troponina positivos, junto con el hallazgo de una trombosis en una vena profunda proximal, tienen mayor riesgo de complicacioners, superando a los biomarcadores cardíacos positivos, y por lo tanto, negando la necesidad de imágenes del ventrículo derecho en el análisis multivariado.
Un análisis post-hoc del estudio PEITHO (es decir, aquellos que ya están en el grupo de riesgo intermedio-alto) sugirió que ≥2 de los siguientes - presión arterial sistólica ≤110 mmHg, frecuencia respiratoria >20/minuto, antecedentes de insuficiencia cardíaca y cáncer activo - se asociaron con mayor riesgo de resultados adversos mayores.
Por lo tanto, parece haber una serie de factores de riesgo asociados con resultados desfavorables, pero hasta ahora no se puede dar una guía clara sobre cuándo administrar la terapia trombólisis/reperfusión.
Por supuesto, al contemplar la trombólisis, no solo debe ser considerada la mortalidad relacionada con la EP sino también el riesgo de sangrado mayor. El factor de riesgo más importante es la edad; los mayores de 65 años tienen mayor riesgo de hemorragia grave.
Equilibrar el riesgo de hemorragia con el riesgo de mortalidad relacionada con la EP requiere la toma de decisiones compartida entre los médicos del paciente, incluido el consentimiento informado.
En los últimos años, ha habido un aumento de los equipos de respuesta al embolismo pulmonar (PERT, por sus siglas en inglés), en particular en EE. UU. y más recientemente en el Reino Unido, para proporcionar asesoramiento experto en tales contextos.
La necesidad de los PERT ha aumentado con el advenimiento de los tratamientos más complejos, como la trombólisis dirigida por catéter, que utiliza dosis muy bajas del lítico, así como el uso potencial de la lisis sistémica a media dosis.
Un metaanálisis reciente ha sugerido que la lisis dirigida por catéter y la lisis con media dosis pueden proporcionar resultados óptimos en términos de reducción de la mortalidad y sangrado, pero los datos de apoyo son relativamente débiles.
Más recientemente, el sistema EKOS®, que administra el fibrinolítico asistido por ecografía, ha demostrado que mejora la relación del diámetro del ventrículo derecho con el izquierdo, con dosis bajas del activador tisular del plasminógeno.
El papel de esta técnica particular y la trombólisis con media dosis aún debe encontrar su lugar en los algoritmos de referencia, y su uso queda a discreción de los clínicos expe4rimentados y los equipos PERT.
Los pacientes con EP de riesgo intermedio-bajo generalmente deben ser internados en el hospital durante un período corto, para iniciar el tratamiento anticoagulante. No existen pautas claras sobre la duración del tratamiento. Hay que admitirlo, dice el autor, pero parece apropiado 48 horas.
Siguiendo las recomendaciones de la guía de la British Thoracic Society, actualmente los pacientes con EP de bajo riesgo pueden ser tratados ambulatoriamente.
Los pacientes en PESI I/II o sPESI 0 pueden ser enviados a su domicilio siempre que no tengan ninguna otra razón social o médica para ser internados. Alternativamente, puede usarse otro conjunto de criterios, conocidos como los criterios de Hestia, que han sido validados específicamente para la selección ambulatoria. Los clínicos pueden desear usar un biomarcador cardiaco negativo para "invalidar" el hallazgo de dilatación del ventrículo derecho en la TC.
Cuando el manejo del paciente se hace en forma ambulatoria, es de suma importancia proporcionarles una buena información y pautas de alarma, un seguimiento cercano después del alta y organizar pruebas adicionales, cuando sea necesario, para hacer otros estudios, como en el caso del cáncer.
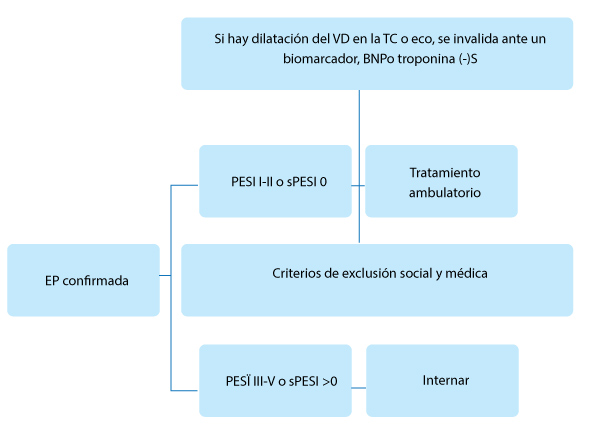 |
Algoritmo de la British Thoracic Society para seleccionar pacientes para tratamiento ambulatorio |
| Anticoagulación |
El pilar del tratamiento de la EP es la anticoagulación. Hasta hace poco, el estándar de atención era la heparina de bajo peso molecular (HBPM) seguida de warfarina, pero en los últimos años ha sido reemplazado por los anticoagulantes orales directos (AOD).
Apixabán, dabigatrán, edoxabán y rivaroxabán han sido licenciados para el tratamiento del tromboembolismo venoso.
El dabigatran y el edoxaban requieren un período de entrada mínimo de 5 días con HBPM, mientras que el apixabán y el rivaroxaban pueden ser administrados tan pronto como se haya confirmado la EP, con un régimen inicial de dosis elevadas que a los 7 y 21 días, respectivamente, se reducen. En general, los AOD, como clase, no son inferiores a HBPM/warfarina en términos de eficacia y parece que tienen menos riesgo de sangrado.
Cuando la anticoagulación está contraindicada por elevado riesgo de sangrado, se pueden usar los filtros de la vena cava inferior, pero es importante eliminarlos tan pronto como sea ´posible administrar la anticoagulación, debido al riesgo de complicaciones a largo plazo. No hay otras ondicaciones de rutina para el uso de estos filtros.
Criterios de exclusión de la British Thoracic Society para el manejo ambulatorio |
• Inestabilidad hemodinámica (FC >110/min, PAS <100 mmHg, Requisito de inotrópicos o cuidados críticos, requerimiento de trombólisis o embolectomía) • Saturación de oxígeno <90% en aire. • Hemorragia activa o riesgo de hemorragia grave (por ej., GI reciente) • Sangrado o cirugía, sangrado intracraneal previo, hipertensión incontrolada). • Anticoagulación de dosis completa en el momento de la EP • Dolor severo (por ej., que requiere analgesia intravenosa) • Enfermedad renal crónica en estadio 4 o 5 (eIFG <30 ml/min) o enfermedad hepática grave • rombocitopenia inducida por heparina en el último año sin alternativa a repetir el tratamiento con heparina. • Otras razones médicas o sociales que requieren una hospitalización para el manejo inicial. |
eIFG, índice de filtrado glomerular estimado; FC, frecuencia cardíaca; GI = gastrointestinal; PAS, presión arterial sistólica. |
| Circunstancias especiales |
> Embarazo
La EP en el embarazo debe manejarse de la misma manera que en pacientes no embarazadas, pero con varias advertencias: no se puede aplicar el puntaje PESI y, por tanto, una decisión sobre si el manejo del paciente puede ser ambulatorio o no deberá tomarse luego de ser discutida entre un médico experimentado y el obstetra. Las pacientes deben ser anticoaguladas con HBPM y no con AOD mientras que el embarazo debe ser considerado una contraindicación relativa de la trombólisis.
> Cáncer
Las pautas actuales recomiendan el uso de HBPM como anticoagulante de primera línea en la trombosis asociada al cáncer, pero 2 estudios de edoxabán y rovaroxabán recientes han demostrado mejor eficacia comparados con la HBPM, aunque con un aumento del sangrado. La International Society of Thrombosis and Haemstosasis han desarrollado una guía para afirmar que cuando el riesgo de sangrado es bajo, estos dos AOD pueden usarse en lugar de la HBPM.
La EP puede ser la característica de presentación de una malignidad subyacente, pero el cribado del cáncer sigue siendo controvertido. En la actualidad, la guía del National Institute for Health and Care Excellence (NICE) sigue recomendando hacer el cribado del cáncer a los pacientes >40 años que sufren por primera vez una EP sin causa aparente, incluyendo el examen físico, análisis bioquímicos, TC abdomino-pélvica y mamografía en las mujeres.
> Trombo en el corazón derecho
La presencia de un trombo en el corazón derecho aumenta el riesgo de mortalidad debido al riesgo de obstrucción del tracto de salida pulmonar y al aumento de la poscarga del ventrículo derecho.
Un coágulo flotante en las cámaras cardíacas derechas debe considerarse una indicación de trombólisis sistémica, pero, si el coágulo se extiende sobre un foramen oval permeable, entonces puede ser apropiada la embolectomía quirúrgica.
En pacientes con coágulos adheridos al endocardio Se prefiere la anticoagulación, a menos que sea móvil y corra el riesgo de obstrucción valvular, en cuyo caso también se puede considerar la cirugía.
> Seguimiento
Es importante que los pacientes deben ser atendidos en una clínica para revisar el resultado del tratamiento, en particular para evaluar la posibilidad de hipertensión pulmonar tromboembólica crónica y determinar la duración de la anticoagulación.
Cuando sea posible, se deberá investigar la malignidad subyacente, lo que también proporciona una red adicional de seguridad. Después de la EP, también hay una gran carga de problemas psicológicos que pueden ser abordados en gran medida por un médico, pero que a veces requiere la derivación al psicólogo.
Resumen y comentario objetivo: Dra. Marta Papponetti