Autor/a: Tevfik F Ismail Acute pericarditis: Update on diagnosis and management
Resumen La pericarditis aguda representa alrededor del 5% de las presentaciones con dolor torácico agudo. La tuberculosis es una causa importante en el mundo en desarrollo, sin embargo, en el Reino Unido y otros entornos desarrollados, la mayoría de los casos son de origen idiopático / viral. Los medicamentos antiinflamatorios no esteroides (AINE) siguen siendo la piedra angular del tratamiento. Al menos uno de cada cuatro pacientes tiene riesgo de recurrencia. La adición de 3 meses de colchicina puede reducir a más de la mitad el riesgo de esto (número necesario a tratar = cuatro). Los esteroides en dosis bajas pueden ser útiles como agentes de segunda línea para tratar las recurrencias como complementos de los AINE y la colchicina, pero no deben usarse como agentes de primera línea. Para los pacientes que fracasan en este enfoque y / o dependen de los corticosteroides, el antagonista de la interleucina-1β anakinra es una opción prometedora, y para los pocos pacientes que son refractarios al tratamiento médico, se puede considerar la pericardiectomía quirúrgica. El pronóstico a largo plazo es bueno con <0.5% de riesgo de constricción para pacientes con pericarditis aguda idiopática. |
Puntos clave
|
Introducción
El saco pericárdico está formado por una capa mesotelial interna que cubre el corazón (visceral) y recubre una capa fibrosa externa sobre la que se refleja el mesotelio (capa parietal). Produce hasta 50 ml de líquido que sirve para lubricar el movimiento del corazón y, en general, sirve para prevenir el movimiento cardíaco excesivo y anclarlo en el mediastino.
La enfermedad del pericardio resulta de la inflamación del pericardio, que a su vez puede dar lugar a un derrame; y rigidez del pericardio que da lugar al síndrome de constricción. El pericardio visceral está inervado por ramas del tronco simpático que transportan fibras aferentes del dolor en una distribución cardíaca y el vago que puede desencadenar reflejos mediados vagalmente en la pericarditis aguda. Por el contrario, el pericardio parietal y fibroso está inervado por ramas somatosensoriales del nervio frénico que pueden dar lugar a un dolor referido al hombro.
Diagnóstico e investigación inicial
La pericarditis es una causa relativamente común de dolor torácico que representa aproximadamente el 5% de todas las admisiones por dolor torácico.
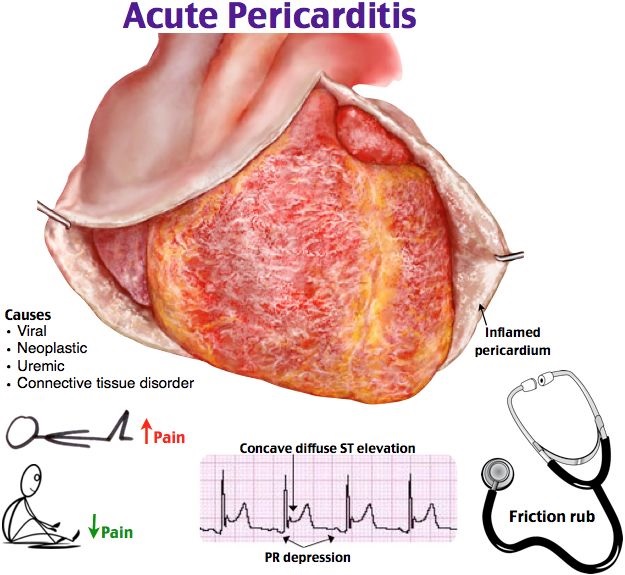
En el Reino Unido, la mayoría de los casos son idiopáticos y probablemente de origen viral, en contraste con la situación en el mundo en desarrollo, donde la tuberculosis es una enfermedad. causa común. Los pacientes se quejan típicamente de dolor en el pecho que es central, peor con la inspiración o al acostarse y mejora al sentarse hacia adelante.
- La auscultación puede revelar un roce de fricción pericárdico característico, aunque esto puede ser evanescente y puede requerir una evaluación repetida para su detección.
- La electrocardiografía (ECG) revela clásicamente una elevación del ST en forma de silla de montar generalizada con depresión PR asociada y es útil para excluir otras causas de dolor torácico .
- La radiografía de tórax suele ser normal a menos que haya un derrame pericárdico considerable.
- Los marcadores inflamatorios (velocidad de sedimentación globular y proteína C reactiva) a menudo se elevan y también puede haber ligeras elevaciones de troponina si hay miopericarditis asociada.
Las elevaciones más significativas y / o las características clínicas o ecográficas de la disfunción ventricular izquierda deberían impulsar la consideración de miocarditis en su lugar o la llamada perimiocarditis donde predomina la afectación miocárdica.
El diagnóstico de pericarditis requiere la presencia de dos de los síntomas o signos típicos:
- dolores torácicos pericárdicos
- frote pericárdico
- elevación del ST y / o depresión de PR generalizada
- derrame pericárdico no trivial nuevo o en aumento.
Si persiste la incertidumbre diagnóstica, la resonancia magnética cardiovascular con imágenes potenciadas en T2 y con realce tardío de gadolinio puede ser útil para confirmar la presencia de cualquier inflamación pericárdica y excluir la miocarditis concomitante y otras diferencias (Figura 1).
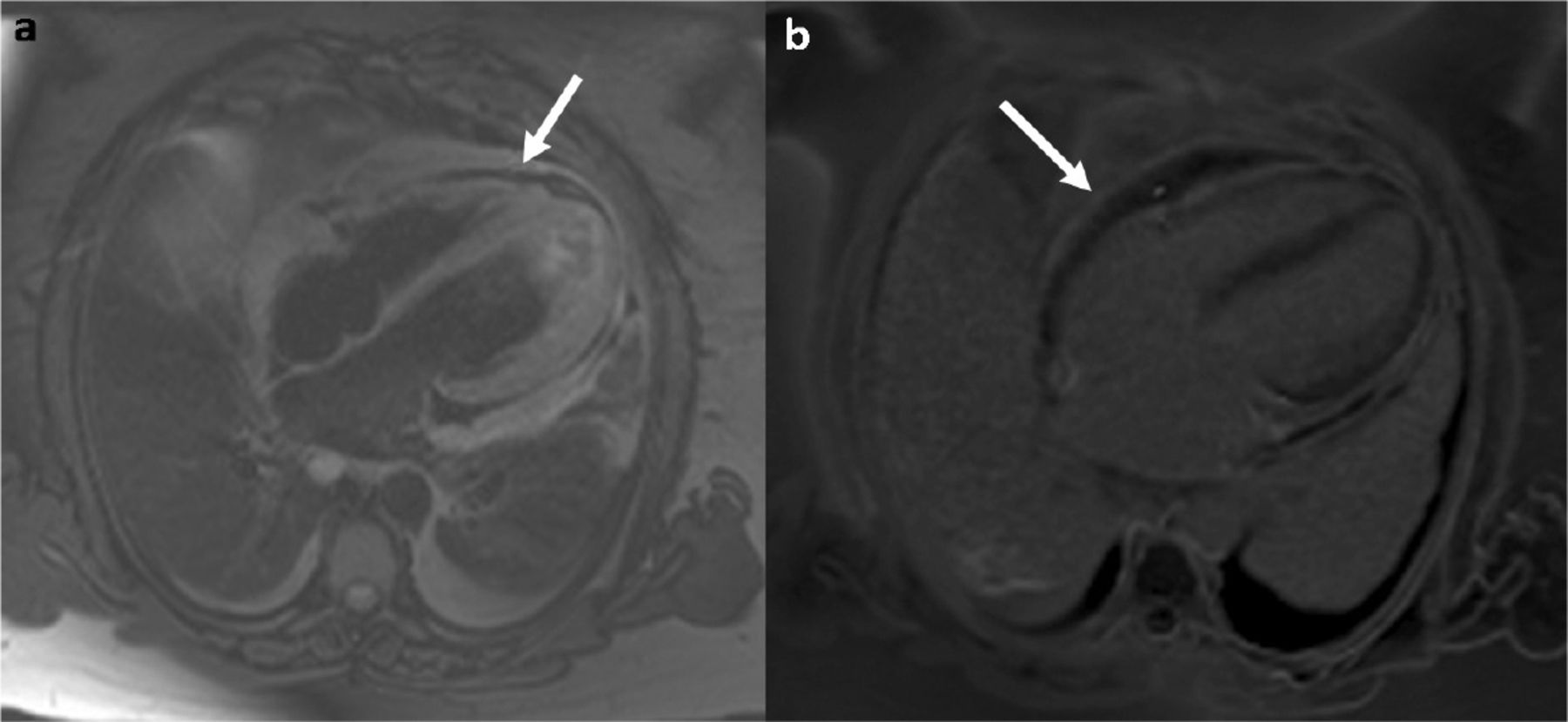
Resonancia magnética cardiovascular en pericarditis aguda. a) Imagen de eco de espín ponderada en T2 que muestra el pericardio con inflamación aguda que parece de señal alta (flecha). También hay derrames pleurales bilaterales asociados. b) Secuencia de realce tardío con gadolinio que revela una captación ávida de contraste por el pericardio inflamado (flecha). El pericardio sano no mejora con el contraste.
Evolución
La mayoría de los casos se resuelven en un mes y el rendimiento de la investigación de un precipitante, en particular la serología viral, es bajo y generalmente no se recomienda.
- Una pericarditis que persiste durante más de 4 a 6 semanas pero menos de 3 meses se denomina incesante.
- La pericarditis que persiste más de 3 meses se denomina crónica.
- Si hay un período de remisión intermedia que dura más de 4 a 6 semanas, se utiliza el término recurrente.
Estos términos son relevantes para la toma de decisiones terapéuticas y las vías de investigación.
Estratificación del riesgo
Un historial completo es un paso vital en la estratificación del riesgo. Varias características clínicas pueden presagiar un mayor riesgo de complicaciones e indicar la necesidad de investigaciones iniciales para pacientes hospitalizados y una búsqueda activa de una etiología:
- fiebre> 38 ° C
- aparición gradual de síntomas
- presencia de un gran derrame (> 20 mm)
- características de fisiología del taponamiento
- falta de respuesta al tratamiento después de 1 semana de antiinflamatorios.
La presencia de miopericarditis, antecedentes de traumatismo, uso de anticoagulantes orales y antecedentes de inmunosupresión se consideran marcadores pronósticos adversos menores que también pueden desencadenar la evaluación hospitalaria.
Tratamiento
Para todos los pacientes, las guías actuales recomiendan la restricción del ejercicio durante la duración de los síntomas y durante al menos 3 meses en los atletas, aunque esto se basa en la opinión de consenso de expertos más que en evidencia sólida.
La pericarditis aguda se puede tratar con un fármaco antiinflamatorio no esteroideo (AINE) como ibuprofeno a 600 mg tres veces al día (tds) durante 1 a 2 semanas, generalmente con un inhibidor de la bomba de protones, disminuyendo una vez que los marcadores inflamatorios se han normalizado típicamente en 400 mg por semana.
Si existen factores de riesgo importantes o antecedentes de enfermedad coronaria, se puede preferir la aspirina al ibuprofeno a una dosis de 900 mg tds durante 1 a 2 semanas, disminuyendo en ∼600 mg por semana a partir de entonces asumiendo que los síntomas se resuelven y los marcadores inflamatorios se normalizan.
La pericarditis puede recurrir hasta en un 30% de los pacientes en un plazo de 1,5 años, y en aproximadamente un 55% de aquellos con una recurrencia previa.
El uso adyuvante de colchicina en la pericarditis aguda durante 3 meses a una dosis de 500 μg dos veces al día ( bd) para aquellos> 70 kg y 500 μg una vez al día si <70 kg aumenta la tasa de remisión en 1 semana y, lo que es más importante, reduce a más de la mitad el riesgo de pericarditis recurrente o incesante (número necesario a tratar = cuatro ).
La colchicina, si bien es segura si se usa adecuadamente, tiene un índice terapéutico estrecho y, por lo tanto, se debe prestar especial atención al prescribir las posibles interacciones medicamentosas y comorbilidades que pueden influir en la farmacocinética del medicamento.
Se deben evitar los corticosteroides si es posible, a menos que exista una enfermedad reumática autoinmune subyacente clara o una contraindicación para los AINE / colchicina, por ejemplo, el embarazo.
Si bien inicialmente es efectivo, el uso de esteroides puede promover la recurrencia y puede atenuar la eficacia de la colchicina si se usa en primera línea. Las razones de esto no están claras, pero se cree que la mayoría de los casos de pericarditis aguda idiopática son de origen viral y que el uso de esteroides pueden promover la replicación viral y retrasar la eliminación, manteniendo así el desencadenante de la inflamación.
Para la pericarditis idiopática, solo deben usarse como complemento después de una prueba de AINE y colchicina para pacientes con enfermedad recurrente. No se requieren dosis superiores a 0,2-0,5 mg / kg / día de prednisolona y aumentan el riesgo de efectos secundarios sin eficacia adicional.
El tratamiento se continúa durante 4 semanas y si los síntomas se resuelven y los marcadores inflamatorios se normalizan, las dosis se reducen gradualmente en 5-10 mg / día cada semana hasta alcanzar los 25 mg y luego en 2,5 mg / día cada 2 semanas hasta alcanzar los 15 mg. El riesgo de recrudecimiento de los síntomas es mayor por debajo de 15 mg, por lo que, a partir de entonces, la disminución gradual se reduce a 1 a 2,5 mg / día cada 2 a 6 semanas. Cuando se reduce gradualmente la medicación, la colchicina debe ser el último fármaco en ser retirado.
Las recurrencias pueden manifestarse con dolor torácico solo sin otras características cardinales de la pericarditis, particularmente cuando la inflamación solo se ha tratado parcialmente. En este contexto, la resonancia magnética cardiovascular puede ser deficiente. valor para confirmar la inflamación en curso.
Para los pacientes que no logran la remisión con enfoques de primera línea (AINE más colchicina) o de segunda línea (AINE más esteroide más colchicina), las opciones terapéuticas de tercera línea incluyen azatioprina, inmunoglobulina intravenosa y anakinra (un antagonista de la interleucina 1β). La azatioprina se usa mejor como un agente ahorrador de esteroides (típicamente en 1 a 3 mg / kg / día) y puede tardar hasta 3 meses en ser eficaz.
El efecto de la inmunoglobulina intravenosa es más inmediato, pero su disponibilidad es restringida y la evidencia para su uso se limita a informes de casos aislados y series de casos pequeñas. No obstante, teniendo en cuenta la posibilidad de sesgo de publicación, parece tener una alta eficacia con un excelente perfil de seguridad.
Existen algunos datos iniciales prometedores para anakinra (2 mg / kg / día hasta 100 mg) en pacientes con> 3 recurrencias. , aumento de los marcadores inflamatorios, resistencia a la colchicina y dependencia de los esteroides. Esto puede estar en consonancia con el papel fundamental que desempeña la interleucina-1 en la respuesta inmune innata, como lo ejemplifican los pacientes con síndromes autoinflamatorios hereditarios.
La pericardiectomía quirúrgica es el tratamiento de último recurso, aunque rara vez se requiere en la práctica clínica y, por lo general, es más necesaria para pacientes con antecedentes de cirugía cardíaca y / o características de constricción que para la pericarditis recurrente idiopática sin complicaciones.
Pronóstico y complicaciones
El pronóstico de la pericarditis aguda idiopática es generalmente excelente con un riesgo muy bajo de secuelas a largo plazo como constricción (<0,5%). La probabilidad de esta última está relacionada con la etiología de la pericarditis más que con el número de episodios.
La constricción pericárica se presenta con signos y síntomas de insuficiencia cardíaca (dificultad para respirar, fatiga, edema / ascitis) pero con una fracción de eyección normal en el eco y, a menudo, un péptido natriurético cerebral normal o mínimamente elevado. Es más probable que se produzca una constricción después de una pericarditis desencadenada por tuberculosis / infección bacteriana, traumatismos y cirugía cardíaca.
El pronóstico de la miopericarditis refleja el de la pericarditis dada la gran superposición de etiología, en particular cuando se conserva la función del ventrículo izquierdo.
Conclusiones La pericarditis aguda es una causa relativamente común de dolor torácico agudo que puede evaluarse fácilmente mediante una anamnesis completa complementada con ECG y ecocardiografía. En el mundo desarrollado, la mayoría de los casos son idiopáticos y si bien el pronóstico con respecto al desarrollo de secuelas adversas es excelente, los episodios agudos y las recurrencias pueden tener un impacto significativo en la calidad de vida y el bienestar de los pacientes. Si bien el estudio de las enfermedades pericárdicas no recibe el mismo grado de atención que los síndromes coronarios agudos, existe una base de evidencia emergente para el tratamiento de la pericarditis aguda idiopática. El uso de colchicina reduce significativamente las posibilidades de recurrencia, pero a pesar de esto, sigue habiendo un subgrupo problemático de pacientes que experimentan múltiples recurrencias. Para este subgrupo, hay algunos datos iniciales prometedores para el antagonista de interleucina-1β anakinra. Sin embargo, nuestra comprensión de la inmunopatología y patogénesis de este síndrome pericárdico sigue siendo incompleta y se requiere más trabajo para abordar esto si se quieren lograr más avances terapéuticos. |